Natriumstearat
Natriumstearat
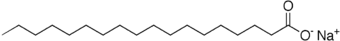
ist das Salz der Stearinsäure, einer langkettigen Carbonsäure. Die chemische Formel lautet: C18H35NaO2. Natriumstearat ist Bestandteil von Kernseifen und als solcher bereits sehr lange bekannt. Bei der reinen Verbindung handelt es sich um einen weißen, wasserlöslichen Feststoff.
Inhalt
Herstellung
Als Ausgangsstoff zur Gewinnung von reinem Natriumstearat dient Tristearin, eine Verbindung die beispielsweise aus dem Talg von Schweinefett extrahiert werden kann. Im traditionellen Herstellungsverfahren wird Tristearin mit Natronlauge gekocht. In dieser sogenannten Verseifungsreaktion wird das Tristearin in Glycerin und Stearinsäure gespalten. Die Stearinsäure wird anschließend durch die Zugabe von Natriumchlorid „ausgesalzt“. Das durch das Löslichkeitsprodukt beschriebene Gleichgewicht zwischen Festkörper, hier das feste Natriumstearat, und den in Lösung vorhandenen Stearatanionen und Natriumkationen wird durch die Zugabe des Natriumchlorids auf die Seite des festen Natriumstearats verschoben. Die Löslichkeit wird herabgesetzt. Dieser Vorgang wird mehrmals wiederholt. Dabei scheidet sich der sogenannte Seifenkern aufgrund seiner geringeren Dichte als feste Masse an der Oberfläche ab, während das Glycerin in der Unterlauge verbleibt.
In den modernen großtechnischen Prozessen erfolgt die Bildung von Natriumstearat auf einem anderen Weg. Im ersten Schritt wird das Fett bei 180°C unter Druck mit Wasserdampf zu freien Fettsäuren hydrolysiert. Das entstandene Glycerin wird von den freien Fettsäuren abgetrennt, die in einem weiteren Schritt durch eine Vakuumdestillation bei niedrigem Druck gereinigt werden. Diese werden daraufhin in eine siedende Natriumcarbonatlösung eingerührt und die Fettsäuren reagieren zu Seife (Natriumstearat), Wasser und Kohlenstoffdioxid.
Schließlich kann für die Herstellung von Natriumstearat nach obigem Verfahren auch direkt Stearinsäure als Ausgangsstoff verwendet werden. Dieses ist ein Bestandteil von Kerzenwachs.
 | |
Allgemeines | |
| Name | Natriumstearat |
| Andere Namen | E 470a (Allgemeine Bezeichnung von Natrium-, Kalium- und Calciumsalzen von Speisefettsäuren) |
| Summenformel | C18H35NaO2 |
| Kurzbeschreibung | weißer geruchloser Feststoff |
Eigenschaften | |
| Molare Masse | 306,46 g·mol−1 |
| Aggregatzustand | fest |
| Dichte | 1,02 g·cm−3 |
| Schmelzpunkt | 205 °C |
| Löslichkeit | löslich in Wasser |
Eigenschaften
Natriumstearate gehören zur Gruppe der Tenside. Sie sind amphiphil, das heißt sie lösen sich sowohl in Wasser als auch in unpolaren Lösungsmitteln, wie z.B. Öl. Diese Eigenschaft ist auf ihre chemische Struktur zurückzuführen: der lange „Fettsäureschwanz“ ist hydrophob und löst sich gut in unpolaren Lösungsmitteln, während die Carboxylgruppe hydrophil ist und sich gut in Wasser und polaren Lösungsmitteln löst. Tenside haben die Eigenschaft, die Oberflächenspannung des Wassers herabzusetzen, indem sie eine monomolekulare Schicht an der Wasseroberfläche bilden. In größeren Konzentrationen kommt es zur Micellenbildung, bei denen die Tensidmoleküle eine Kugel (= energetisch günstigste Form) bilden.
Hierbei zeigen in einer wässrigen Lösung die hydrophoben Bestandteile nach innen, während die hydrophilen Bestandteile nach außen in Richtung Wasser zeigen. Auf dieser Eigenschaft beruht auch die Verwendung als Emulgator: hierbei taucht der lipophile Teil in unpolare Flüssigkeiten, zum Beispiel Öl, während der hydrophile Teil in die polare Flüssigkeit taucht. Auf diese Weise können beispielsweise Öltröpfchen im Inneren einer Micelle in Lösung gehalten werden – die Emulsion ist stabil und entmischt sich nicht. Analog funktioniert die Stabilisierung einer Wasser-in-Öl-Mischung.
Verwendung
Natriumstearat ist ein Hauptbestandteil von Kernseifen. Diese bestehen aus einer Mischung verschiedener Fettsäuresalze, wie Natriumpalmitat oder Natriumoleat. Auch in anderen Reinigungsmitteln findet es Verwendung, da es als Tensid die Reinigungswirkung unterstützt. Weiterhin wird Natriumstearat aufgrund seiner amphiphilen Eigenschaften gerne als Emulgator in Shampoos oder Crèmes eingesetzt. Es unterstützt die Bildung stabiler Emulsionen, verhindert deren Entmischung und trägt damit insgesamt zur Haltbarkeit dieser Produkte bei.
Ein verwandtes Einsatzgebiet ist die Kosmetik. Hier wird Natriumstearat als Quellmittel für desodorierende Stifte oder Kühlstifte auf Alkoholbasis eingesetzt. Schließlich ist es die Basis für die Herstellung von fettfreien Salben. In der Lebensmittelindustrie wird Natriumstearat ebenfalls gerne verwendet. Es ist ein unter der E-Nummer E470a zugelassener Lebensmittelzusatzstoff und wird als Verdickungsmittel oder Emulgator eingesetzt. Man findet es in Margarine, Pudding, Schokolade und unterschiedlichen Backwaren.
Schließlich gibt es eine letzte, weniger bekannte Anwendung in der Kunststoffindustrie. Hier wird Natriumstearat als Nukleierungsmittel Polymerschmelzen zugesetzt. Bei einigen thermoplastischen Kunststoffen erfolgt beim Abkühlen der Polymerschmelze eine teilweise Kristallisation. Diese wird beispielsweise durch Staub oder Hilfsstoffe, wie Farbstoffe oder ähnliches, ausgelöst, die als Kristallisationskeim wirken. Die Bildung dieser Kristallite ist unerwünscht, da sie ab einer bestimmten Größe die mechanischen Eigenschaften und die Transparenz des Kunststoffes negativ beeinflussen. Durch die Zugabe sogenannter Nukleierungsmittel wird eine gleichmäßigere und höhere Zahl an Kristallisationskeimen erreicht. Die Größe der Kristallite bleibt kleiner, die Schmelze erstarrt schneller und die Eigenschaften des Kunststoffs werden verbessert.
Sicherheitshinweise und Risiken
Im Umgang mit Natriumstearat sind keine besonderen Risiken zu beachten. Allgemein reagieren Natriumstearate in Wasser schwach alkalisch.
Natriumstearat kaufen
Natriumstearat kann in verschiedenen Packungsgrößen und Gebinden über den Chemikalienhandel bei verschiedenen Lieferanten bestellt werden.
