Chloroform (Trichlormethan)
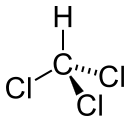
Chloroform, dessen korrekte chemische Bezeichnung Trichlormethan lautet, gehört zur Gruppe der Halogenkohlenwasserstoffe und hat die Summenformel CHCl3. Es ist eine bei Raumtemperatur farblose und leicht flüchtige Flüssigkeit mit einem charakteristischen, süßlichen Geruch. Es ist vor allem als Narkosemittel bekannt und wurde lange Jahre als solches verwendet, bevor seine toxische Wirkung bekannt wurde.
Inhalt
Herstellung
Die Herstellung von Chloroform erfolgt industriell durch Umsetzung von mit Chlor und Methan bzw. Chlormethan bei Temperaturen von 400-500°C. Bei dieser radikalischen Substitutionsreaktion werden die Wasserstoffatome des Methans bzw. Chlormethans schrittweise durch Chloratome ersetzt. Dabei entstehen neben Trichlormethan auch Chlormethan, Dichlormethan und Tetrachlormethan. Diese müssen in einem anschließenden Destillationsschritt voneinander getrennt werden.
Zwei weitere Herstellungsmethoden sind ebenfalls bekannt, werden allerdings nicht in großindustriellem Maßstab durchgeführt. Bei der sogenannten Photochlorierung werden Chlorgas und Methan unter Lichteinwirkung umgesetzt; hierbei handelt es sich ebenfalls um eine radikalische Substitutionsreaktion. Schließlich lässt sich Chloroform durch Umsetzung von Natriumhypochlorit oder Chlorkalk mit Aceton herstellen. Hierbei entsteht in alkalischer Lösung neben Chloroform als weiteres Produkt Essigsäure.
Eigenschaften
Chloroform ist eine bei Raumtemperatur farblose Flüssigkeit mit einem charakteristischen, süßlichen Geruch. Es ist leicht flüchtig und die Dämpfe haben betäubende Wirkung. Chloroform ist in Wasser nicht, in organischen, also unpolaren Flüssigkeiten, wie Ether, Benzol, Ölen und Fetten dagegen gut löslich. Dies ist auf den ersten Blick ungewöhnlich, denn wenn man sich die Strukturformel von Chloroform betrachtet, so handelt es sich um ein polares Molekül. Auch das Dipolmoment von 1,01 bestätigt die starke Polarität dieses Moleküls.
Andererseits löst sich Chloroform nicht in polaren Lösungsmitteln, wie es eigentlich zu erwarten wäre. Dies ist darauf zurückzuführen, dass Chloroform keine Wasserstoffbrücken ausbilden kann – und sich daher nicht in Wasser oder anderen Lösungsmitteln, die Wasserstoffbrücken ausbilden, löst. Bei Chloroform handelt es sich um ein sogenanntes polar-aprotisches Lösungsmittel.
Bei der Lagerung ist zu beachten, dass Chloroform in braunen Glasflaschen und dunkel gelagert werden sollte. Unter Einfluss von Licht bzw. von Sauerstoff an der Luft zersetzt sich Chloroform unter Bildung von Chlorwasserstoff und dem gefährlichen Atemgift Phosgen. Durch Zusatz von ca. 1% Ethanol wird eine Chloroformlösung zusätzlich stabilisiert, da dieses mit sich bildendem Phosgen direkt weiterreagiert.
 | |
Allgemeines | |
| Name | Chloroform |
| Andere Namen |
|
| Summenformel | CHCl3 |
| CAS-Nummer | 67-66-3 |
| Kurzbeschreibung | farblose Flüssigkeit mit süßlichem Geruch |
Eigenschaften | |
| Molare Masse | 119,38 g·mol−1 |
| Aggregatzustand | flüssig |
| Dichte | 1,48 g·cm−3 (20 °C) |
| Schmelzpunkt | −63 °C |
| Siedepunkt | 61 °C |
| Dampfdruck | 209 hPa (20 °C) |
| Löslichkeit | schlecht in Wasser (8,2 g·l−1 bei 20 °C) |
Verwendung
Seit Mitte des 19. Jahrhunderts bis vereinzelt in die siebziger Jahre des zwanzigsten Jahrhunderts setzten Ärzte ihre Patienten durch „Chloroformieren“ in Narkose und setzten damit gleichzeitig das Schmerzempfinden ihrer Patienten herab. Heute wird Chloroform aufgrund seiner schädigenden Wirkung auf innere Organe, vor allem auf Leber und Herz, als Narkosemittel nicht mehr verwendet.
Aufgrund seiner guten Lösemitteleigenschaften jedoch als Lösungsmittel. Außerdem liegt sein Einsatzbereich hauptsächlich bei der Herstellung der sogenannten Fluorchlorkohlenwasserstoffe (FCKW) sowie für diverse chemische Reaktionen.
Dazu gehört beispielsweise die Herstellung der Triphenylmethan-Farbstoffe, bei dem es in einem Zwischenschritt zur Darstellung von Dichlorcarben benötigt wird, welches dann weiterreagiert zum gewünschten Endprodukt. In der Kernresonanzspektroskopie wird deuteriertes Chloroform als Lösungsmittel verwendet, bei dem das Wasserstoffatom durch ein Deuterium ersetzt ist. Dadurch ist es möglich, eine Probe sehr genau zu vermessen und zusätzliche Messfehler, die durch nicht-deuteriertes Lösungsmittel entstehen, zu vermeiden.
Schließlich wird bei der sogenannte Chloroform-Fumigations-Extraktion die mikrobielle Biomasse in Böden bestimmt. Hierbei wird Chloroform eingesetzt, um die im Boden vorhandenen Zellen zu lysieren, das heißt aufzubrechen, und die Probe anschließend weiterzuverarbeiten.
Chloroform kaufen
Chloroform wird nicht an Privatpersonen abgegeben, sondern nur an Gewerbetreibende, die die nötige Sachkunde aufweisen. Über den Chemikalien- oder Laborhandel können Gewerbetreibende diese Chemikalie beziehen.
Sicherheitshinweise und Risiken
Chloroform sollte, wie bereits beschrieben, unter Licht- und Luftausschluss an einem dunklen Ort aufbewahrt werden, um Zersetzung zu vermeiden. Es wirkt reizend auf Augen und Haut, hat narkotische Wirkung und hebt die körpereigene Schmerzsensorik auf. Über die Lungen werden Chloroformdämpfe gut resorbiert und rasch im Körper verteilt.
Über körpereigene Enzyme wird es zu Phosgen und Chlorwasserstoff zersetzt, welches teilweise im Körper unschädlich gemacht, teilweise aber auch zu Zellschädigungen führen kann. Somit ist bei der Arbeit mit Chloroform entsprechende Schutzkleidung zu tragen und vor allem auf eine gute Be- und Entlüftung zu achten.
Gemäß der EU-Gefahrstoffkennzeichnung ist es als gesundheitsschädlich eingestuft. Weiterhin gilt Chloroform als krebserregend und teratogen (fruchtschädigend). Die Entsorgung erfolgt als gefährlicher Abfall gemäß den gesetzlichen Vorschriften.
